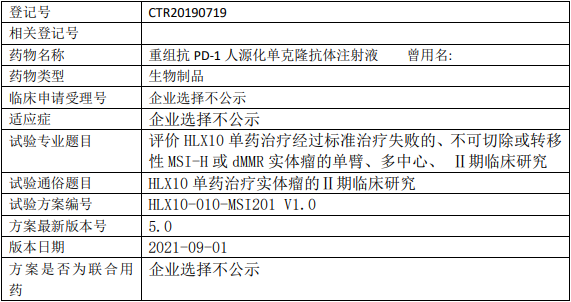
复宏汉霖HLX10临床试验,评价重组抗PD-1人源化单克隆抗体HLX10(斯鲁利单抗、Serplulimab、汉斯状)注射液单药治疗经过标准治疗失败的、不可切除或转移性MSI-H或dMMR实体瘤的II期临床试验
试验目的
主要目的
评估HLX10在标准治疗后发生疾病进展或不可耐受毒性反应的不可切除或转移性MSI-H或dMMR实体瘤患者中的临床疗效。
次要目的
评估HLX10在标准治疗后发生疾病进展或不可耐受毒性反应的不可切除或转移性MSI-H或dMMR实体瘤患者中的安全性和耐受性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、自愿参加临床研究;完全了解、知情本研究并签署知情同意书(InformedConsentForm,ICF);愿意遵循并有能力完成所有试验程序。
2、签署ICF时年龄≥18岁,且≤75岁。
3、本研究入组受试者病理组织标本要求如下:
●第一阶段:经中心实验室或研究中心病理组织学或者细胞学检查确诊的,存在MSI-H或dMMR的不可切除或转移性的恶性实体瘤患者;
●第二阶段:经病理组织学或细胞学确诊的不可切除或转移性的恶性实体瘤,且需中心实验室检查确认为MSI-H的患者。
4、第一阶段:既往接受过现有标准抗癌治疗后(至少一线治疗后)发生疾病进展,或不耐受或者拒绝接受后续治疗。
注:对于根治性同步放化疗、新辅助/辅助治疗(化疗或放化疗),如果在治疗期间或停止治疗后6个月内发生疾病进展,应将其算作一线治疗失败;如果超过半年,则不能算作一线治疗失败。患者在接受一线化疗治疗过程中,发生首次药物不能耐受,需要进行药物减量,如果药物用量在标准剂量的50%仍然不能耐受,才符合不能耐受化疗的标准。其中,结直肠癌的标准一线治疗指以氟尿嘧啶类为基础的化疗。
第二阶段:既往接受过现有标准抗癌治疗后发生疾病进展,或不耐受。
注:结直肠癌患者需接受过三药(氟尿嘧啶类、伊立替康、奥沙利铂)治疗,胃癌患者需至少接受二线标准治疗失败,其他患者需至少接受一线标准治疗失败。对于根治性同步放化疗、新辅助/辅助治疗(化疗或放化疗),如果在治疗期间或停止治疗后6个月内发生疾病进展,应将其算作一线治疗失败;如果超过半年,则不能算作一线治疗失败。患者在接受化疗治疗过程中,发生首次药物不能耐受,需要进行药物减量,如果药物用量在标准剂量的50%仍然不能耐受,符合不能耐受化疗的标准或者首次药物不能耐受,研究者判断化疗药物相关的不良反应CTCAE≥3级,也符合不能耐受化疗的标准。
5、既往系统性抗肿瘤治疗结束距本研究首次用药必须≥2周,且治疗相关AE恢复至NCI-CTCAEv5.0≤1级(2级脱发除外)。既往使用过中药、中成药、免疫调节剂(如胸腺肽、香菇多糖、白介素-12等)结束距开始研究用药必须≥2周。
6、由IRRC根据RECIST1.1版要求评估的至少有一个可测量病灶。注:可测量靶病灶不能选自既往放疗部位。如果既往放疗部位的靶病变量是唯一一个可选靶病灶,研究者需提供显示该病灶明显进展的前后影像学数据。
7、受试者必须提供肿瘤组织及血样以进行MSI、肿瘤突变负荷(TumorMutationalBurden,TMB)、PD-L1表达水平测定(上述指标已具有本研究所指定中心实验室检测结果的受试者可不用再次检测,第二阶段不需检测TMB)。
注:建议提供首次研究用药前6个月内,采集于非放疗部位,经福尔马林固定的肿瘤组织样本。石蜡包埋的肿瘤标本(首选),或福尔马林固定石蜡包埋(formalinfixedparaffnembed-ded,FFPE)肿瘤标本或未染色新切的连续组织切片(载玻片)。还必须提供上述标本的相关病理报告。新鲜采集标本、切除术、空心针芯活检、切除、切开、冲压或钳夹活检均在可接受范围内(首选新获得的组织)。不接受针吸样本(即缺乏完整的组织结构仅提供细胞悬液和/或细胞涂片的样本)、刷涂样本、来自胸腔或腹腔积液的细胞沉淀样本。组织样本要求详见实验室操作手册。
8、研究药物首次用药前7天内的ECOG体力状况评分是0或1。
9、预期生存时间≥12周。
10、乙肝表面抗原(HBsAg)检查呈阴性。HBsAg(+)和/或乙肝核心抗体(HBcAb)(+)的受试者满足以下条件也允许入组:入组时必须HBV-DNA<2000IU/mL或104拷贝/mL,若高于该标准,则首先接受抗病毒治疗,要求下降至正常范围至少2周,且必须在研究期间全程继续接受抗病毒治疗。若筛选时正在接受抗病毒治疗的受试者,必须在研究期间全程继续接受抗病毒治疗
11、主要器官功能正常,且符合下列标准(在本研究首次用药前14天内,未接受过输血、白蛋白、重组人促血小板生成素或集落刺激因子(CSF)治疗)。
12、女性受试者必须满足:
①绝经(定义为至少1年内无月经,且除绝经之外无其他确认原因),或者;
②已行手术绝育(摘除卵巢和/或子宫),或者;
③具有生育能力,但必须满足:首次用药前7天内的血清妊娠试验必须为阴性,而且在整个试验过程及试验药物末次给药后至少120天内须采用有效的避孕措施避孕,而且不得哺乳。
13、男性受试者必须在整个试验过程及试验药物末次给药后至少120天内采用有效的避孕措施避孕。
排除标准
1、准备进行或者既往接受过器官或骨髓移植的受试者。
2、通过适当干预后无法控制的胸腔积液、心包积液或腹水。
3、已知或筛选期检查发现患有活动性中枢神经系统转移和/或癌性脑膜炎者。但允许以下受试者入组:
1.无症状性脑转移受试者(即没有脑转移灶引起的进行性中枢神经系统症状,不需要皮质类固醇,且病变大小≤1.5cm)可以参加,但需要作为疾病部位定期进行脑部影像学检查;
2.经治疗后的脑转移受试者,且脑转移病灶稳定至少1个月,没有新的或扩大的脑转移证据,且本研究药物首次给药前3天停用类固醇。这个定义中稳定的脑转移应在研究药物首次给药前确定。
4、手术和/或放疗未能根治性治疗的脊髓压迫,或既往诊断的脊髓压迫经治疗后没有临床证据显示在研究药物首次用药前疾病稳定≥1周的受试者。
5、影像学检查显示,存在明确的肿瘤侵犯胸部大血管表现。
6、研究药物首次用药前半年内发生过脑血管意外(除外腔隙性脑梗塞、轻微脑缺血或短暂性脑缺血发作等)、心肌梗塞、不稳定心绞痛、控制不良的心律失常(包括QTc间期男性≥450ms、女性≥470ms)(QTc间期以Fridericia公式计算)。
7、按照美国纽约心脏病学会(NYHA)标准(附录三)Ⅲ级或Ⅳ级心功能不全或心脏彩超检查:左室射血分数(LVEF)<50%。
8、存在CTCAEv4.03≥2级的外周神经病变。
9、人类免疫缺陷病毒(HIV)感染。
10、HBsAg或HBcAb阳性,且HCV抗体阳性者。
11、患有活动性肺结核病。
12、既往或目前有间质性肺炎、尘肺、放射性肺炎、药物相关肺炎、肺功能严重受损等可能会干扰可疑的药物相关肺毒性的检测和处理。
13、存在已知活动性或可疑自身免疫病。允许入组处于稳定状态且不需要全身免疫抑制剂治疗者。
14、研究药物首次用药前28天内接受过活疫苗的治疗。
15、研究药物首次用药前14天内或研究期间,需要全身使用皮质类固醇(>10mg/天泼尼松或等效剂量的同类药物)或其他免疫抑制剂治疗的受试者。但以下情况允许入组:在没有活动性自身免疫疾病的情况下,允许吸入或局部外用类固醇或剂量≤10mg/天泼尼松疗效剂量的肾上腺激素替代治疗。
16、研究药物首次用药前14天内,出现任何需要系统性给予抗感染治疗的活动性感染。
17、研究药物首次用药前28天内,接受过重大手术,本研究重大手术定义:术后至少需要3周恢复时间,才能够接受本研究治疗的手术。肿瘤穿刺或淋巴结切取活检允许入组。
18、研究药物首次用药前3个月内,接受过根治性放射治疗。注:允许接受骨的姑息性放疗或浅表病灶的姑息性放疗,疗程参照当地的标准,且在首次用药前14天已经结束。不允许首次给药前28天内接受覆盖30%以上骨髓区域的放疗。
19、在研究期间可能会接受其他抗肿瘤治疗,如化疗、靶向治疗或放疗(姑息性放疗除外)。
20、既往接受过任何T细胞共刺激或免疫检查点治疗,包括但不限于细胞毒性T淋巴细胞相关抗原-4(cytotoxicTlymphocyte-associatedantigen-4,CTLA-4)抑制剂、PD-1抑制剂、PD-L1/2抑制剂或其他靶向T细胞的药物。
21、正在参加其他临床研究的治疗阶段,或计划开始本研究治疗距离前一项临床研究药物治疗结束时间不足14天。
22、已知对任何单克隆抗体或研究药物辅料有严重过敏史。
23、妊娠期或哺乳期女性。
24、已知有精神类药物滥用或吸毒史。同意在研究期间不饮酒的受试者可以入组。
25、经研究者判断,受试者具有其他可能导致本研究被迫中途终止的因素。
