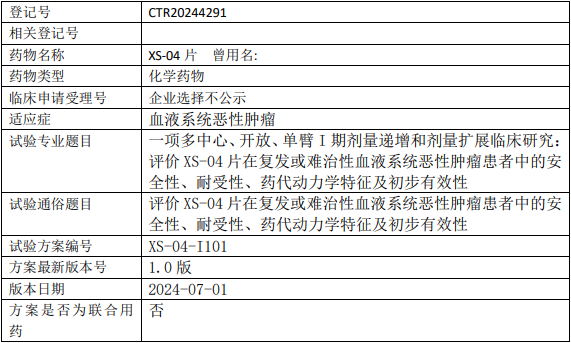
星盛新辉XS-04临床试验,评价XS-04片治疗复发或难治性血液系统恶性肿瘤安全性、耐受性、药代动力学特征及初步有效性的I期临床试验
试验目的
主要目的
1、评价XS-04片在复发或难治性血液系统恶性肿瘤患者中的安全性和耐受性;
2、确定XS-04片最大耐受剂量(Maximal tolerated dose,MTD)和/或II期临床研究推荐剂量(Recommended phase 2 dose,RP2D)。
次要目的
1、确定XS-04片单次、多次口服给药后的药代动力学(Pharmacokinetics, PK)特征;
2、初步评价XS-04片在复发或难治性血液系统恶性肿瘤患者中的疗效。
探索性目的
1、初步评估患者口服 XS-04片后的代谢转化特征;
2、评估群体PK和暴露-效应(E-R)关系;
3、探索相关生物标志物与药物疗效的关联;
4、探索PD生物标记物与PK的相关性;
5、评估食物对患者口服XS-04片的PK特征影响。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、自愿参加临床试验,并签署知情同意书(ICF)。
2、年龄≥18周岁,≤75岁,不限性别。
3、剂量递增阶段:按2017年WHO分类标准,组织病理确诊的成熟B细胞恶性肿瘤患者,经现有治疗手段治疗失败且无合适治疗者且具有治疗指征。
剂量扩展阶段:按2017年WHO分类标准,组织病理确诊的B细胞淋巴瘤患者(队列一纳入DLBCL患者,队列二纳入其他B细胞淋巴瘤患者),以及按2016 年WHO分类,确诊的髓系肿瘤患者(队列三纳入AML、MDS患者); 符合以下疾病特定标准(以下没有列出的瘤种,将由申办者和研究者共同讨论后决定能否入组):
a.对于惰性B-NHL(滤泡淋巴瘤、边缘区淋巴瘤和华氏巨球蛋白血症),要求既往接受过至少2线全身治疗且至少1线含抗CD20抗体的联合治疗方案;对于慢性淋巴细胞白血病/小淋巴细胞淋巴瘤,要求既往接受过至少2线全身治疗,包括BTK抑制剂或BCL-2抑制剂;对于MCL,要求既往接受过至少2线全身治疗(包括抗CD20抗体、BTK抑制剂等治疗方案);对于侵袭性B-NHL(DLBCL),要求既往接受过至少2线全身治疗失败或复发,且不适合接受造血干细胞移植者;
b.对于AML,根据 2016 年WHO分类确诊的AML,符合《中国复发难治性急性髓系白血病诊疗指南(2021年版)》复发难治的定义:
a)复发性AML:CR后外周血再次出现白血病细胞或骨髓中原始细胞≥5%(除外巩固化疗后骨髓再生等其他原因)或髓外出现白血病细胞浸润;
b)难治性AML:经过标准方案治疗2个疗程无效的初治病例;CR后经过巩固强化治疗,12个月内复发者;在12个月后复发但经过常规化疗无效者;2次或多次复发者;髓外白血病持续存在者;
c. 对于MDS,存在病理确诊的符合WHO 2016 分类标准的MDS;且预后积分系统评估为中高危患者(IPSS-R评分>3),复发难治:
a)复发性 MDS:根据 IWG 2006 疗效评估标准,在获得完全缓解或部分缓解或血液学改善后,至少出现下列 1 项:
①骨髓原始细胞回升到治疗前水平;
②中性粒细胞或血小板计数较最佳疗效下降超过50%;③血红蛋白下降超过15 g/L或依赖输血;
b)难治性 MDS:去甲基药物治疗至少4周期未获得缓解;去甲基药物治疗期间发生疾病进展的患者;或对去甲基药物治疗不耐受的患者
4、B细胞淋巴瘤患者必须存在至少1个影像学可测量病灶(即长径[LDi]>1.5cm的淋巴结,LDi>1.0cm的淋巴结外病灶)。
5、患者须愿意接受骨髓穿刺和/或骨髓活检。
6、美国东部肿瘤协作组(Eastern cooperative oncology group,ECOG)评分剂量爬坡阶段0-1分;剂量扩展阶段0-2分。
7、预期生存时间≥3个月。
8、对于成熟B细胞恶性肿瘤,在筛选期,根据当地实验室参考范围,有足够的不依赖于生长因子支持的骨髓,参考范围如下:
a.中性粒细胞绝对计数(ANC)≥1.0×10^9/L(根据研究者的意见,由于淋巴瘤骨髓浸润导致中性粒细胞<1.0×10^9/L的患者可以入组);
b.血小板≥75×10^9/L(剂量爬坡阶段),血小板≥50×10^9/L(剂量扩展阶段),在首次给药前14天内未输血;
c.血红蛋白≥80 g/L。 对于AML白细胞计数(WBC)需≤20×10^9/L(允许服用羟基脲降白细胞治疗)。
9、有适当的器官功能,首次给药前 7 天内的实验室检查符合以下要求:
a.肝功能:血清天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)≤2.5×ULN,总胆红素≤1.5×正常值上限(ULN);如果有肝脏侵犯,则AST、ALT≤5×ULN;总胆红素≤3×ULN;
b.肾功能:血清肌酐≤1.5×ULN 或依据 Cockcroft-Gault 公式(见附录5)估算的肌酐清除率≥50 mL/min;
c.凝血功能:国际标准比值(INR)或凝血酶原时间(PT)≤1.5×ULN;活化部分凝血时间(aPTT)≤1.5×ULN。
10、筛选期育龄期女性患者在首次给药前7天内血清妊娠试验检查结果呈阴性。患者并同意自签署知情同意书至最后一次给药后3个月内使用可靠的方法避孕。包括但不限于:禁欲、男性接受输精管切除术、女性绝育手术、有效的宫内节育器、有效的避孕药物。
11、患者能够遵守研究程序和方案规定的访视。
排除标准
1、伯基特淋巴瘤/白血病、浆细胞骨髓瘤、浆母细胞淋巴瘤。
2、急性早幼粒细胞白血病(APL)或BCR-ABL阳性的AML患者或既往有骨髓增殖性疾病(MPN)病史。
3、首次接受研究药物前14天内或5个半衰期之内使用过其他细胞毒性药物、研究药物或其他抗肿瘤药物(以较短者为准)(羟基脲和白细胞分离术除外)。首次接受研究药物前4周内接受过肿瘤免疫治疗、抗体类、多肽类抗肿瘤药物治疗的患者。
4、首次接受研究药物前4周内接受过除诊断、活检、引流术外的其他治疗性手术,或预期将在研究期间接受重大手术的患者。对于接受研究药物前4周内进行过引流术(如胸腔、胆道等)和/或放置引流管的患者,要求相关症状/体征已基本缓解,无需预防性/治疗性使用抗生素。
5、首次接受研究药物前4周内接受过系统性放疗。
6、既往抗肿瘤治疗的毒性反应尚未恢复(> NCI-CTCAE 5.0 1级),脱发、色素沉着、神经毒性或其他经研究者评估已转为慢性且不影响研究用药安全性的毒性恢复到NCI-CTCAE 5.0 2级或以下允许入组)。
7、既往接受过异体干细胞移植;首次接受研究药物前3个月内(成熟B细胞恶性肿瘤患者)或6个月内(AML、MDS患者)接受过自体干细胞移植或过继免疫细胞治疗。
8、存在淋巴瘤/白血病侵犯中枢神经系统(CNS)的患者。
9、吞咽困难,或者有严重胃肠道疾病史(如活动期炎症性肠病、胃肠道穿孔)且相关症状无法合理控制的患者;或有影响药物吸收的胃肠道疾病(如克罗恩病、溃疡性结肠炎、肠梗阻、短肠综合征)或其他吸收不良情况。
10、眼部结膜、角膜病变患者(经治疗眼部病变痊愈后可入组);
11、患有活动性或不稳定的心脑血管疾病,包括但不限于:
a.需要临床干预的严重的心脏节律或传导异常;
b.首次给药前6个月内发生急性冠脉综合征、充血性心力衰竭、心肌梗死、不稳定型心绞痛、冠状动脉/外周动脉旁路移植术、脑梗死、脑出血、肺栓塞、深静脉血栓形成(首次给药前3个月内)或其他严重心血管事件;
c.美国纽约心脏病协会(NYHA,见附录4)心功能分级≥II级;
d.左室射血分数(LVEF)<50%;
e.存在尖端扭转型室性心动过速、先天性长QT综合征;
f.静息状态下,3次心电图平均QTcF>450ms(男性)或>470ms(女性);
g.尽管接受了最佳治疗,无法控制的高血压(定义为在药物控制情况下,收缩压≥160 mmHg 或舒张压≥100 mmHg)。
12、有间质性肺病 (ILD)、肺间质纤维化病史;或筛选期胸部CT扫描发现活动性肺炎证据。
13、患有先天性免疫缺陷疾病,或活动性自身免疫性疾病,包括但不限于患有活动性且无法控制的自身免疫性血细胞减少症,持续2周或更长时间,包括自身免疫溶血性贫血和特发性血小板减少性紫癜。
14、患有凝血障碍性疾病(例如血友病)。
15、正在使用抗凝药物。
16、既往有严重过敏史者,或对研究药物的任何活性或非活性成分过敏者。
17、研究药物首次给药前两周内存在未控制的全身感染(病毒、细菌、真菌);乙肝表面抗原阳性且乙型肝炎病毒DNA超过1000 IU/ml;丙肝病毒(HCV)抗体阳性或 HCV RNA 阳性;人类免疫缺陷病毒(HIV)抗体阳性。
18、患有其他原发性恶性肿瘤,以下情况可以入组:治愈且完全切除的基底细胞和鳞状细胞皮肤癌、完全切除的任何类型的原位癌。
19、研究用药前2周内仍需要继续使用全身免疫抑制剂或全身性皮质类固醇(≥10mg强的松或其当量的其它皮质类固醇)者。
20、首次给药前2周内使用过CYP3A强抑制剂或强诱导剂。
21、妊娠期、哺乳期妇女。
22、根据研究者判断,其它任何严重或未控制的急慢性疾病或实验室检查异常或存在其他原因不适合参加本临床研究。
