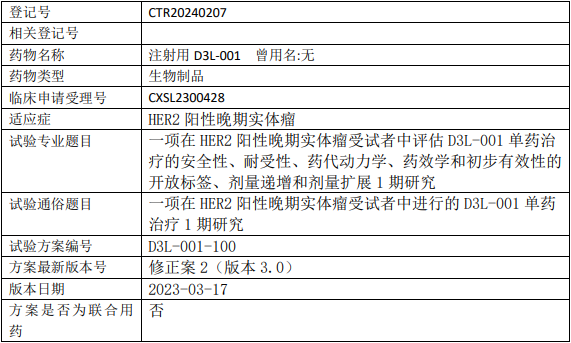
德昇济D3L-001临床试验,评估注射用D3L-001单药治疗HER2阳性晚期实体瘤安全性、耐受性、药代动力学、药效学和初步有效性的I期临床试验
试验目的
主要目的
1、评价D3L-001在HER2阳性实体瘤成人受试者中的安全性和耐受性;
2、确定最大耐受剂量(MTD)(如适用)和2期推荐剂量(RP2D)。
次要目的
1、表征D3L-001的PK特征;
2、评价免疫原性(免疫原性定义为抗药抗体(ADA)的发生率);
3、评价D3L-001单药治疗HER2阳性晚期实体瘤的肿瘤缓解情况。
试验设计
试验分类:其他其他说明:安全性、耐受性、药代动力学、药效学和初步疗效
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、受试者能够理解并自愿签署知情同意书(ICF)且遵守研究限制。
2、签署知情同意书时,受试者必须≥18岁。
3、在过去5年内,通过对最近一次肿瘤活检获得的肿瘤组织进行当地检测,证实受试者为HER2阳性(通过免疫组化[IHC]、原位杂交[ISH]、二代测序[NGS]或其他适当的分析技术确定)。当地HER2检测必须依据当地法规或美国临床肿瘤学会(ASCO)/美国病理学家学会(CAP)HER2检测指南(如适用)使用经证实和充分验证的检测方法进行。
4、受试者的东部肿瘤协作组(ECOG)体能状态评分必须为0或1分。
5、在筛选期内,通过超声心动图(ECHO)或多门控采集扫描(MUGA)得出的受试者的左心室射血分数(LVEF)必须≥50%。
6、筛选期内受试者必须具备研究方案表6中定义的充分的器官和骨髓功能。
排除标准
1、受试者既往接受过任何抗CD47或SIRPα药物治疗。
2、受试者在研究药物首次给药前28天未完成的大手术或放疗、免疫刺激剂、试验用药物或任何其他抗癌治疗(包括化疗、靶向治疗、生物制剂)。在开始研究药物治疗之前,这些治疗的毒性必须已消退或充分稳定。
3、受试者在研究药物首次给药前14天未完成免疫抑制药物治疗。
4、受试者患有不受控制的并发疾病,会限制对研究要求的依从性、大幅增加发生AE的风险或损害受试者给出书面知情同意书的能力。
5、受试者因既往抗癌治疗而存在未缓解的NCICTCAE≥2级治疗相关毒性(白癜风或脱发除外)。
6、研究者认为:如果受试者不太可能遵守研究程序、限制和要求,则受试者不应参加研究。
