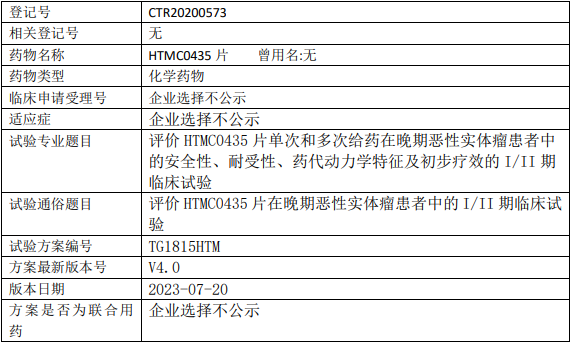
汇伦生命/壹典医药HTMC0435临床试验,评价HTMC0435片单次和多次给药治疗晚期恶性实体瘤安全性、耐受性、药代动力学特征及初步疗效的I/II期临床试验
试验目的
主要目的
评价HTMC0435片单次和多次给药在晚期恶性实体瘤患者中的安全性和耐受性,探索最大耐受剂量(MTD)和剂量限制性毒性(DLT),明确II期临床推荐给药剂量(RP2D)。
次要目的
1、评价HTMC0435片单次和多次给药的药代动力学特征;
2、初步观察HTMC0435片在晚期恶性实体瘤患者的有效性;
3、考察生物标志物的表达水平与HTMC0435抑瘤活性的关系。
试验设计
试验分类:安全性和有效性
试验分期:其它 其他说明:I/II
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至81岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄≥18周岁且<81周岁,性别不限;
2、剂量递增阶段:标准治疗失败或缺乏标准治疗方案,经组织学或细胞学确诊的晚期实体瘤患者;
3、剂量扩展阶段:标准治疗失败或缺乏标准治疗方案,经组织学或细胞学确诊的晚期卵巢癌、乳腺癌、前列腺癌、胰腺癌患者;
4、预期生存时间≥3个月;
5、ECOG体力状况评分为0~1;
6、首次给药前2周内检查指标中,无严重的造血功能异常,心、肺、肝、肾功能基本正常;
7、理解并自愿签署书面知情同意书,有意愿和能力完成定期访视、治疗计划、实验室检查及其他试验过程。
排除标准
1、既往接受过聚腺苷二磷酸核糖聚合酶抑制剂治疗者;
2、在首次给药前4周内接受过化疗、放疗、生物治疗、内分泌治疗、免疫治疗等抗肿瘤治疗;
3、既往抗肿瘤治疗的不良反应尚未恢复到CTCAE 5.0等级评价≤1级(脱发等研究者判断无安全风险的毒性除外);
4、具有临床症状的中枢神经系统转移或脑膜转移,或有其他证据表明患者中枢神经系统转移或脑膜转移灶尚未控制,经研究者判断不适合入组者;
5、患有严重心脑血管疾病史者;
6、既往或当前诊断的骨髓增生异常综合征(MDS)或急性髓性白血病(AML);
7、妊娠或哺乳期女性,或有生育计划的男性和女性受试者(包括男性受试者的育龄女性配偶);
8、活动性感染性疾病,且需要系统性抗感染治疗者;
9、存在严重的心理或精神异常,影响受试者参加本临床研究的依从性;
10、研究治疗前4周内进行过大型手术且未完全恢复;
11、研究治疗前4周内接受过任何临床试验药物治疗者;
12、除上述情况外,研究者认为不宜入选本研究的患者。
