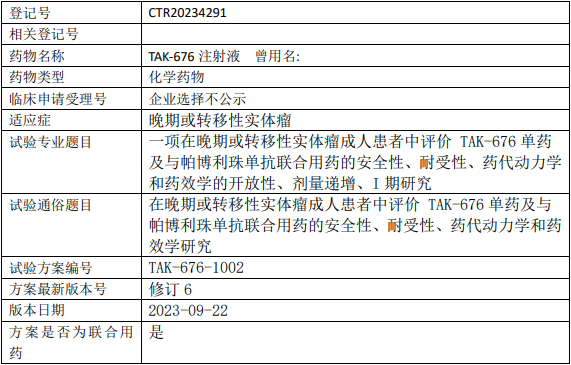
武田TAK-676临床试验,评价TAK-676注射液单药及与帕博利珠单抗联合用药治疗晚期或转移性实体瘤安全性、耐受性、药代动力学和药效学的I期临床试验
试验目的
剂量递增阶段
确定TAK-676作为SA给药或与帕博利珠单抗联合用药递增剂量治疗晚期或转移性实体瘤患者的安全性和耐受性。
扩展阶段
确定TAK-676与帕博利珠单抗联合或不联合化疗治疗既往未经治疗的转移性或不可切除的复发性SCCHN患者的安全性和耐受性;
确定TAK-676与帕博利珠单抗联合治疗既往接受过治疗的复发性局部晚期或转移性MSI-H/dMMRCRC和MSS/pMMRCRC患者的安全性和耐受性。
试验设计
试验分类:其他其他说明:安全性、耐受性、和药效学(样本检测单位:昆皓睿诚医药研发(北京)有限公司,中国,北京)
试验分期:I期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄满18岁的成人男性或女性患者。
2、美国东部肿瘤协作组体能状态评分为0至1分。
3、充分的骨髓、肾脏、肝脏和心脏功能,如方案中的详述。
4、在第1部分中,在血液中观察到TAK-676对先天性和/或适应性免疫系统的药效学刺激的外周证据后,及/或在至少1例患者中观察到临床缓解(CR/PR)后,随后的患者必须:至少有1处病变适合活检。同意进行2次肿瘤活检:1次在筛选期间,1次在TAK-676治疗的第1周期第15天。
5、在第2部分和第3部分中,患者必须愿意接受强制性的治疗前和治疗期间肿瘤活检。一旦采集到目标数量的活检,就不需要额外采集配对的治疗前和治疗期间活检。
6、患者必须至少有1个根据RECIST v.1.1可评价的病变。仅在剂量递增阶段(第1部分),仅不可测量的疾病是可接受的。
排除标准
1、在首次研究药物给药前≤6个月内,有以下任何一种医学史:充血性心脏衰竭(纽约心脏协会III级或IV级)、不稳定型心绞痛、心肌梗死、最佳药物治疗后仍有持续性高血压≥160/100mmHg、>2级持续性心律失常(包括心房扑动/颤动或间歇性室性心动过速)、其他持续性严重心脏病(例如,3级心包积液或3级限制性心肌病),或有症状的脑血管事件。允许使用稳定抗凝疗法(包括低分子量肝素)治疗慢性稳定性心房颤动。
2、筛选期间12导联ECGFridericia校正QT间期>450ms(男性)或>475ms(女性)。
3、筛选或C1D1给药前评估期间≥2级低血压(即需要非紧急干预的低血压)。
4、筛选或C1D1给药前评估期间室内空气中的血氧饱和度为<92%。
5、在过去6个月内接受过其他STING激动剂/拮抗剂和Toll样受体激动剂治疗的患者。
6、在研究药物治疗C1D1后90天内主动吸电子烟。
7、主动吸烟
8、肺部炎症、间质性肺病、重度慢性阻塞性肺病、特发性肺纤维化、其他限制性肺部疾病、急性肺栓塞或≥2级胸腔积液或腹水的当前医学史,无法通过穿刺控制或需要留置导管。
9、脑转移医学史,除非:既往手术、全脑放疗或立体定向放射外科治疗后临床稳定(即≥6周),并且未使用皮质类固醇。
10、持续性≥2级感染或≥2级恶性发热的患者。
11、已知有不受控制的自身免疫类疾病、HIV感染或其他相关先天性或获得性免疫缺陷医学史。
12、慢性活动性肝炎(如已知乙型肝炎表面抗原血清学阳性和/或可检测到丙型肝炎病毒RNA的患者)。o备注:乙型肝炎核心抗体阳性的患者可以入组,但不得有可检测出的血清乙型肝炎病毒DNA。丙型肝炎病毒抗体阳性的患者不得有可检测出的丙型肝炎病毒RNA血清水平。
13、在研究药物治疗C1D1之前14天内进行放疗(对肺部的放疗为42天)和/或42天内进行全身放射性核素治疗。既往接受放射治疗后出现临床相关持续肺部并发症的患者不符合条件。
14、使用全身性皮质类固醇或其他免疫抑制治疗,同时或在研究药物治疗C1D1后7天内使用,但以下情况除外:
●外用、鼻内、吸入、眼部、关节内和/或其他非全身性皮质类固醇;
●替代类固醇治疗的生理剂量(如肾上腺功能不全);
●对于参加第2B部分的患者,可根据当地标准治疗实践进行类固醇化疗前驱用药。
15、同时或在研究药物治疗C1D1后14天内使用已知临床有机阴离子转运多肽(OATP)1B1和/或OATP1B3抑制剂的药物。有关OATP1B1和/或OATP1B3抑制剂的非详尽列表,请参阅研究案。
16、在研究药物治疗C1D1的28天内接种减毒活疫苗(如卡介苗、口服脊髓灰质炎疫苗、麻疹、轮状病毒、黄热病)。
17、异基因或自体干细胞移植或器官移植的受者。
