肺癌没有基因突变怎么办,能吃靶向药吗
肺癌,其死亡率居恶性肿瘤之首。为了加深大家对肺癌防治、诊疗和康复等知识的了解,医脉通携手肿瘤科医生,为广大癌友及家属答疑解惑~
图片来源于网络,侵权请联系删除
本期要点
1.肺癌患者没有基因突变可以盲吃靶向药吗?
2.无缘靶向治疗还有哪些治疗方式?
3.有这么多的治疗方式,该如何选择?
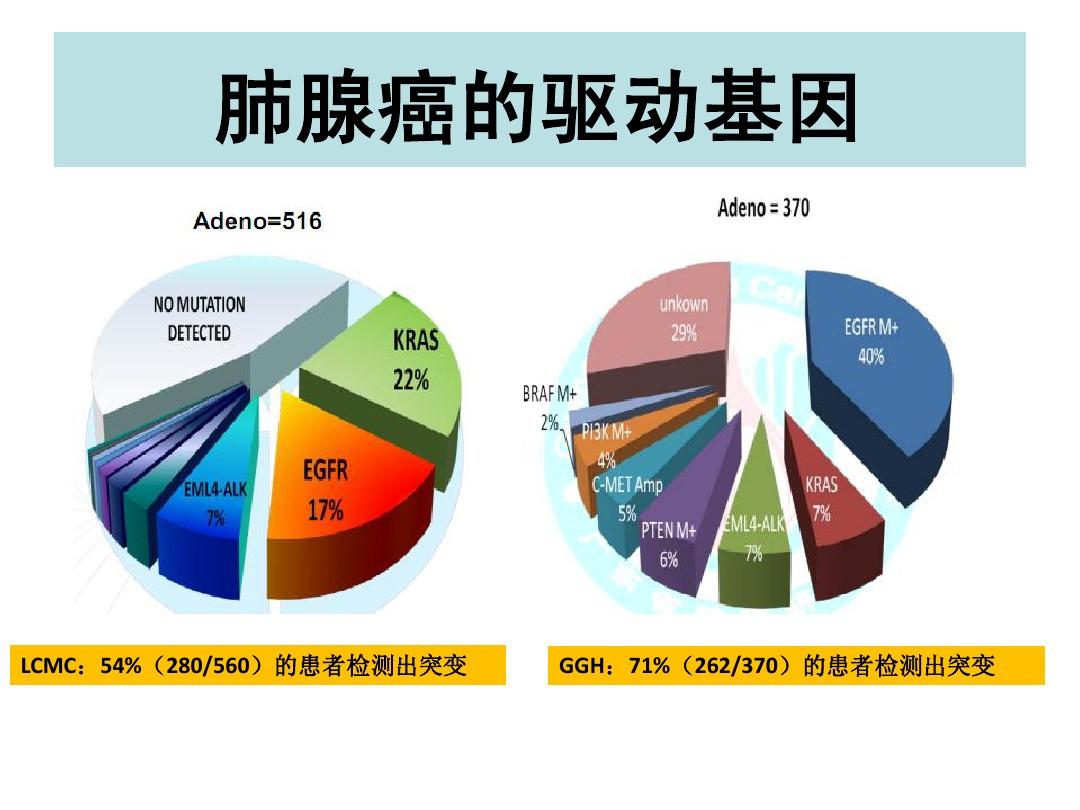
随着靶向治疗的出现,晚期非小细胞肺癌(NSCLC)的生存得到大大提高。然而只有1/3的NSCLC患者(腺癌中70%左右)具有可靶向的的驱动基因突变,可以接受靶向药物的治疗,改善生存。
那么没有可用的靶向药物的晚期NSCLC患者该怎么办呢?
01、没有基因突变可以盲吃靶向药吗
首先要明确的第一个问题,没有驱动基因突变可以盲吃靶向药吗?
在晚期非小细胞肺癌首个靶向药物吉非替尼获批的历程中,多项研究证明,没有相应的驱动基因突变,靶向药物是无效的。
吉非替尼于2003年5月美国FDA加速获批,但是却在3期确证性研究中(吉非替尼与安慰剂对比二线治疗晚期非小细胞肺癌随机研究)发现,由于未选择人群,吉非替尼总生存未优于安慰剂,因此于2005年被FDA限制使用。
最后在2009年IPASS研究中确证了只有EGFR敏感突变的患者才能从吉非替尼靶向治疗中生存获益。
而随着认识的深入,我们还发现盲吃靶向药会导致病情的延误,经济的损失以及毒性的增加。
因此在没有驱动基因突变的情况下,不建议盲吃靶向药。
02、无缘靶向治疗还有哪些治疗方式
对于无缘靶向治疗的患者,传统治疗方式主要是化疗,不过目前已经出现新的治疗手段,并且有越来越多的患者受益,主要有以下7种治疗方案。
含铂双药化疗方案(含培美曲塞,吉西他滨化疗单药维持治疗)
对于无缘靶向治疗的患者,多项研究证明含铂双药化疗方案相较于最佳支持治疗(营养支持对症治疗)提高生存。
1995发表的一项荟萃分析显示,含铂(顺铂,卡铂)的化疗方案较最佳支持治疗为晚期非小细胞肺癌患者带来生存获益,1年生存率提高10%,因此奠定了含铂化疗方案的一线治疗地位。含铂双药化疗为驱动基因阴性NSCLC患者的经典治疗方案。
顺铂和紫杉醇、顺铂和吉西他滨、顺铂和多西他赛或卡铂和紫杉醇4个三代含铂两药方案疗效相似,总生存<1年[1]。
维持治疗是随着培美曲塞这种较低毒性化疗药物的出现而发展出的治疗模式。多项研究证实,培美曲塞的维持治疗可以延长生存。吉西他滨对于一般情况较好的患者维持治疗也有生存获益。
含铂双药化疗方案联合抗血管生成药物:较含铂双药化疗提高生存。
2006年发表的Ⅲ期E4599研究首次将晚期非小细胞肺癌的生存期延长超过1年[2] 。
中国的beyong研究也证实化疗联合贝伐珠单抗较含铂两药化疗取得生存获益。另一项中国研究长春瑞滨加顺铂联合恩度也较长春瑞滨+顺铂取得生存获益。
PD-1/PDL1抑制剂单药:较化疗提高生存。
近10年来,程序性死亡受体-1(PD-1)/程序性死亡受体配体-1(PD-L1),细胞毒性T淋巴细胞相关抗原4(CTLA4)为靶点的免疫检查点抑制剂(ICIs)可调节机体自身的免疫反应以发挥抗肿瘤作用,在驱动基因阴性NSCLC的治疗中取得了突破性的进展。
多项研究数据表明,PD-L1高表达(TPS≥50%)的NSCLC患者抗PD-1或抗PD-L1抗体单药治疗较含铂双药化疗有显著生存获益。
并且在进一步研究发现,PD-L1低表达的患者,不能耐受化疗的情况下,也可以选择PD-1/PDL1单抗单药治疗。
KEYΝΟTE-024的长期随访结果显示,PD-1单抗的5年总生存为31.9%,较化疗组16.3%显著获益[3]。奠定了PDL1高表达患者免疫单药一线治疗的地位。
KEYNOTE-042研究[4]进一步将入组人群标准扩大至PD-L1TPS≥1%,结果显示PD-1单抗较化疗也取得生存获益,主要改善了PDL1表达≥50%的人群,在≥20%及≥1%也有获益趋势,但没有达到统计学差异。
IPSOS研究[5]提示,抗PDL1单抗(阿替利珠单抗)比较单药化疗在无驱动基因突变、体能状态不好(PS较差≥2分)或 > 70岁有并发症不适合接受含铂双药化疗的局部晚期/转移性NSCLC中疗效更好,总生存延长(10.3个月 vs 9.2个月,HR=0.78,P=0.028),有效率提高分别为16.9%和7.9%。
含铂双药化疗方案联合免疫检查点抑制剂:较化疗提高生存。
肿瘤细胞被化疗药物杀伤后可释放肿瘤抗原,激活免疫系统,诱导肿瘤细胞PD-L1表达,化疗的基础上添加免疫治疗能取得更好的疗效[6]。
多项研究分别证实,化疗基础上联用PD1/PDL1单抗较含铂双药化疗可以为晚期NSCLC患者带来生存获益,相应抗PD1/PDL1药物也得到获批适应症。KEYNOTE-189长期随访数据表明,免疫联合化疗较化疗五年生存延长,5年生存率率分别为19.4%对比11.3%[7]。
含铂双药方案联合免疫检查点抑制剂(ICIs)联合贝伐珠单抗:较含铂双药化疗方案联合贝伐珠单抗有生存获益。
ICIs与抗血管生成药物具有协同作用[8]。IMpower150研究是首个证实免疫治疗联合抗血管治疗和化疗一线治疗晚期NSCLC患者无进展生存及总生存均获益的Ⅲ期临床研究。
在高肿瘤负荷,肝转移,KRAS基因突变合并STK11基因突变和或KEAP1基因突变等预后不良的人群中,显示较化疗联合抗血管改善生存 [9]。
PD1单抗联合CTLA4单抗+/-化疗:生存获益好于含铂双药化疗。
基于CheckMate 227和CheckMate 9LA试验的结果[10,11],相比单纯化疗,纳武利尤单抗(PD-1单抗)+伊匹木单抗(CTLA4单抗)和纳武利尤单抗+伊匹木单抗+化疗均可明显延长PD-L1任何表达患者的总生存。
但双免为主的方案药物的组合复杂、不良反应发生率高,应谨慎对待。目前国内指南推荐级别较低。
单药化疗
老年,体弱(PS评分2)的晚期肺癌患者,含铂双药化疗耐受性差,长春瑞滨节拍化疗,多西他赛周疗,白蛋白紫杉醇周疗,吉西他滨单药等在有限的研究中提示生存获益,联合治疗不比单药效果更佳且副作用更大。
03、这么多的治疗方式,该如何选择
由以上研究可以看出,免疫检查点抑制剂的应用大大提高了晚期非小细胞肺癌的5年生存率,因此驱动基因阴性的晚期非小细胞肺癌的一线治疗模式发生了根本变化,以免疫检查点抑制剂+/-化疗的模式取代了以化疗为基石的治疗。
对于晚期非小细胞肺癌,确诊的时候除了驱动基因检测,指南推荐PD-L1的检测。
(1)对PD-L1高表达≥50的患者,建议PD-1或PD-L1单抗单药治疗,如果疾病迅速进展并有疾病相关的严重症状需要迅速缩瘤的,可以联合化疗。
(2)低表达或阴性的患者,建议化疗联合PD1或PDL1单抗,非鳞癌患者特别有不良预后因素的可在这基础上联合抗血管生成治疗(贝伐珠单抗)。低表达患者不能耐受化疗的可以PD1/PDL1单药治疗。
(3)有免疫治疗禁忌的人群,如器官移植,活动性感染,自身免疫性疾病等患者,考虑化疗为基础的综合治疗。年老体弱有免疫治疗禁忌的人群建议单药化疗或最佳支持治疗。
综上所述,由于靶向,免疫治疗的进一步发展,晚期非小细胞肺癌的治疗迈入精准化个体化治疗时代,晚期非小细胞肺癌患者(尤其腺癌患者)确诊时需明确基因突变状态及PDL1表达水平。
有驱动基因突变的患者,以靶向治疗为主。驱动基因阴性患者,免疫+/-化疗已经取代化疗成为一线治疗的新选择。
参考资料
[1] Schiller JH, Harrington D, Belani CP, et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J]. N Engl J Med, 2002, 346(2): 92-98.
[2] Sandler A, Gray R, Perry MC, et al. Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer[J]. N Engl J Med, 2006, 355(24): 2542-2550
[3] Reck M, Rodríguez-Abreu D, Robinson AG, et al. Five-Year Outcomes With Pembrolizumab Versus Chemotherapy for Metastatic Non-Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score ≥ 50[J] . J Clin Oncol. 2021;39(21):2339-2349.
[4]Pembrolizumab versus chemotherapy for previously untreated,PD-L1-expressing,locally advanced or metastatic non-small-cell lung cancer(KEYNOTE-042):a randomised,open-label,controlled,phase 3 trial.Lancet,2019
[5] Lee SM, Schulz C, Prabhash K, et al. LBA11 IPSOS: Results from a phase Ⅲ study of first-line (1L) atezolizumab (atezo) vs single-agent chemotherapy (chemo) in patients (pts) with NSCLC not eligible for a platinum-containing regimen[J]. Ann Oncol, 2022, 33(7_suppl): S1418-1419.
[6] Galluzzi L, Buqué A, Kepp O, et al. Immunological effects of conventional chemotherapy and targeted anticancer agents[J]. Cancer Cell, 2015, 28(6): 690-714.
[7]Garassino MC, Gadgeel S, Speranza G, et al. Pembrolizumab Plus Pemetrexed and Platinum in Nonsquamous Non–Small-Cell Lung Cancer: 5-Year Outcomes From the Phase 3 KEYNOTE-189 Study. Journal of Clinical Oncology 2023:JCO.22.01989
[8] Fukumura D, Kloepper J, Amoozgar Z, et al. Enhancing cancer immunotherapy using antiangiogenics: Opportunities and challenges[J]. Nat Rev Clin Oncol, 2018, 15(5): 325-340.
[9] Socinski MA, Jotte RM, Cappuzzo F, et al. Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC[J]. N Engl J Med, 2018, 378(24): 2288-2301.
[10] Brahmer JR, Lee JS, Ciuleanu TE, et al. Five-year survival outcomes with nivolumab plus ipilimumab versus chemotherapy as first-line treatment for metastatic nonsmall-cell lung cancer in CheckMate 227[J]. J Clin Oncol, 2023, 41(6): 1200-1212.
[11]Paz-Ares L, Ciuleanu TE, Cobo M, et al. First-line nivolumab plus ipilimumab combined with two cycles of chemotherapy in patients with non-small-cell lung cancer (CheckMate 9LA): An international, randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2021, 22(2): 198-211.
内容来源:医脉通癌友指南
