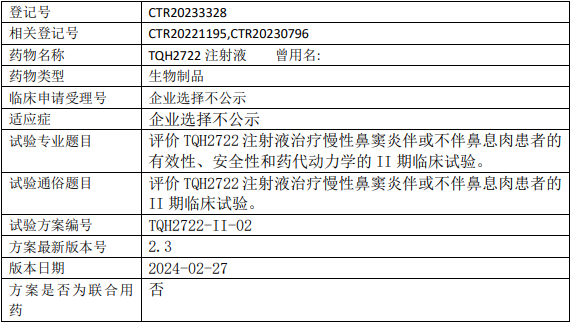
正大天晴TQH2722临床试验,评价TQH2722注射液治疗慢性鼻窦炎伴或不伴鼻息肉有效性、安全性和药代动力学的II期临床试验
试验目的
评价TQH2722注射液在慢性鼻窦炎(CRS)伴或不伴鼻息肉患者中的有效性、安全性以及多次给药的药代动力学特征。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄18-75周岁,性别不限。
2、符合《中国慢性鼻窦炎诊断和治疗指南(2018)》诊断标准的双侧慢性鼻窦炎(伴或不伴鼻息肉)。
3、在筛选期之前,受试者必须使用较稳定剂量的鼻用糖皮质激素(INCS)超过4周。对于在筛选前使用INCS替代产品而非MFNS的受试者,受试者愿意在在研究期间改用MFNS。
4、在筛选期之前,受试者必须曾经使用过较稳定剂量的鼻用糖皮质激素(INCS)超过4周。对于在筛选前使用INCS替代产品而非MFNS的受试者,受试者愿意在在研究期间改用MFNS。
5、合并哮喘的受试者在筛选期前至少4周内开始吸入稳定剂量的糖皮质激素治疗,并可接受在整个研究期间吸入糖皮质激素剂量维持不变。
6、导入期患者愿意进行日记每日症状评估及保持稳定剂量的MFNS且依从性至少为70%的受试者。
7、能够阅读和理解,并愿意签署知情同意书。
8、受试者及伴侣同意整个研究期间(从筛选/导入期开始到末次用药后3个月)采取有效的避孕措施。
9、特殊入选标准:仅对A部分1)在筛选和随机时,经鼻内镜评估的双侧鼻息肉评分(NPS)≥5,且每侧鼻孔评分≥2。
10、特殊入选标准:仅对A部分2)筛选时(日评分)及随机时(周平均评分)鼻塞评分(NCS)≥2。
11、特殊入选标准:仅对A部分3)在筛选之前,同时持续存在下述症状至少8周:①鼻塞。②其他任一症状如嗅觉减退/丧失或流涕。
12、仅对B部分1)在随机化之前,参与者必须在CT扫描中有双侧鼻窦炎症且双侧LMK总分≥8分,并且双侧筛窦浑浊。
13、仅对B部分2)在访视1和随机时,经鼻内镜检查确认无鼻息肉。
14、仅对B部分3)受试者必须在访视1前至少连续4周持续有嗅觉减退症状。
15、仅对B部分4)在筛选时,受试者存在中度或重度嗅觉丧失症状(嗅觉丧失评分≥2分)且随机时的周平均严重程度≥2分。
16、仅对B部分5)受试者在筛选时(日评分)和随机时(周平均评分)时的sTSS(NC、鼻涕、面部疼痛/压力)必须≥2分。
17、仅对B部分6)筛选前2年内或筛选时至少有1次血常规显示血液嗜酸性粒细胞满足以下任一条件的参与者:
1)血嗜酸性粒细胞计数≥0.25*10^9/L;
2)血液嗜酸性粒细胞百分比≥6.9%且受试者不伴有哮喘;
3)血液嗜酸性粒细胞百分比≥3.7%且受试者伴有哮喘。
排除标准
1、筛选期或随机时存在以下任意一条实验室检查值异常:
●丙氨酸氨基转移酶(ALT)或天冬氨酸氨基转移酶(AST)>2.5正常上限(ULN);
●总胆红素>2xULN(继发于Gilbert综合征的间接胆红素升高除外);
●肌酐>1.5×ULN。
2、研究者认为不稳定并可能影响患者在整个研究期间的安全性、或影响研究结果或其解读、或妨碍患者完成整个研究过程的能力的任何疾病,包括但不限于心血管、胃肠、肝、肾、神经、肌肉骨骼、感染、内分泌、代谢、血液学疾病、精神病或重大肢体障碍。例如但不限于:缺血性心脏病、左心室衰竭、心律失常、未控制的高血压、未控制的高血糖、脑血管疾病等。
3、患有活动性自身免疫性疾病患者(包括但不限于,桥本甲状腺炎、Graves病、炎症性肠病、原发性胆汁性胆管炎、系统性红斑狼疮、多发性硬化和其他神经炎症性疾病、寻常性银屑病、类风湿性关节炎)。
4、已知或疑似免疫抑制者,包括但不限于有侵袭性机会感染(如组织胞浆菌病、李斯特菌病、球孢子菌病、肺囊肿病、曲菌病)病史,即使感染已消退。
5、有活动性恶性肿瘤或具有恶性肿瘤病史的受试者:患有基底细胞癌、皮肤局限性鳞状细胞癌或宫颈原位癌的患者,如果在访视1前患者完成治愈性治疗已经至少12个月,则可以入组本研究、患有其他恶性肿瘤的患者,如果在访视1前患者完成治愈性治疗已经至少5年,则可以入组本研究。
6、筛选前12月内存在活动性肺结核病史。
7、筛选期存在活动性肝炎,或者乙型肝炎表面抗原(HBsAg)阳性,或者乙型肝炎核心抗体(HBcAb)阳性且HBV-DNA阳性,或者HCV抗体阳性且HCV-RNA阳性。或人类免疫缺陷病毒抗体(Anti-HIV)阳性,或梅毒螺旋体抗体(Anti-TP)阳性。
8、筛选期前6个月内诊断为蠕虫寄生虫感染,未接受标准治疗或标准治疗无效。
9、接受了以下治疗的受试者:
a)筛选(访视1)前6个月内进行过鼻窦手术或鼻腔鼻窦手术;
b)筛选前8周或者5个半衰期内(以时间较长者为准)接受过单克隆抗体类药物治疗,包括但不限于贝利珠单抗、美泊利单抗、奥马珠单抗、白藜芦单抗、度普利尤单抗、其他同类药物(IL-4R抑制剂)等;
c)在筛选前8周或者5个半衰期内(以时间较长者为准)接受过免疫抑制剂治疗(包括但不限于环磷酰胺、环孢素、干扰素γ、硫唑嘌呤、甲氨蝶呤、麦考酚酯和他克莫司等);
d)筛选前8周或者5个半衰期(以时间较长者为准)内使用其他非生物制剂类试验药物;
e)筛选访视(访视1)前30天内静脉注射免疫球蛋白(IVIG)治疗和/或进行过血浆置换;
f)在随机前四周接受白三烯拮抗剂/调节剂的受试者(随机前连续使用稳定剂量的白三烯调节剂≥30天的受试者可以入组);
g)在筛选前3个月内开始过敏原免疫治疗,或计划在研究期内开始该治疗或计划在研究期间改变治疗剂量;
h)筛选前4周内接种过减毒活疫苗或计划在研究期间接种减毒活疫苗;
i)筛选前4周内使用全身性糖皮质激素;
j)筛选前2周内或筛选导入期间,患慢性活动性或急性感染需要使用抗生素、抗病毒药、抗寄生虫药、抗原虫药,或者抗真菌药的全身性治疗,或者随机前4周内患有可能尚未接受抗病毒治疗的病毒感染性疾病。
10、合并哮喘的患者如果存在以下情况,则需排除:
a.第一秒钟用力呼气量(FEV1)≤正常预计值的50%,或;
b.筛选前90天内哮喘急性加重,需要住院治疗(>24小时),或;
c.正在使用每日剂量高于1000mcg氟替卡松或等效的吸入性糖皮质激素(ICS)。
11、受试者存在使其无法完成筛选期评估或无法评价主要疗效终点的伴随疾病,例如:
a)鼻中隔偏曲导致至少一个鼻孔阻塞;
b)筛选时或筛选前2周内发生急性鼻窦炎、鼻部感染或上呼吸道感染;
c)持续性药物性鼻炎;
d)诊断为嗜酸性肉芽肿性血管炎(Churg-Strauss综合征)、肉芽肿性多血管炎(韦格纳肉芽肿)、杨氏综合征、Kartagener综合征或其他纤毛运动障碍综合征、囊性纤维化;
e)影像学怀疑,或确诊为真菌性鼻-鼻窦炎。
12、患有鼻腔恶性肿瘤和良性肿瘤(例如,乳头状瘤、血管瘤等)的受试者。
13、无法使用MFNS或对糠酸莫米松鼻喷剂过敏或不耐受的受试者。
14、对任何生物制剂有全身性过敏史(局部注射部位反应除外)的受试者。
15、妊娠期或哺乳期女性。
16、酗酒、吸毒和已知有药物依赖性者。
17、在筛选前12周内参加过其它医疗器械的临床试验(以末次使用医疗器械日期计算)。
18、受试者在研究中依从性不佳,经研究者判断无法完成本研究。
19、根据研究者或申办方医学审核员判断,认为存在使受试者面临风险、干扰参加研究或干扰研究结果解释的任何医学或精神症状。
